|
2018/10
No.142 |
1. 巻頭言 | 2. リオンホールにおける響きの調整 | 3. ICSV 25 | 4. 注射剤管理用液中パーティクルカウンタKL-05 | |||||||
|
|
|||||||||||
<技術報告>
![]() 注射剤管理用液中パーティクルカウンタKL-05
注射剤管理用液中パーティクルカウンタKL-05
リオン株式会社 微粒子計測機開発課 長 部 航
■ はじめに
医薬業界において、注射剤中への異物混入には細心の注意が払われている。これは患者への異物投入が最悪の場合、生命の危機に陥るためである。そのため、現在の日本では第十七改正日本薬局方(Japanese Pharmacopoeia: JP)に従い、製造工程や品質管理で厳重に検査された医薬品が処方・投薬されている。
光遮蔽型パーティクルカウンタは不溶性微粒子の迅速な測定が可能な機器として、医薬品製造現場で日々使用されている。ここでは、この度新たに開発した光遮蔽型パーティクルカウンタKL-05を紹介する。図1にKL-05 の外観を示す。
 |
|
図1 環境騒音観測システム 構成図
|
■ 概 要
KL-05の主な仕様を表1に示す。本器は光遮蔽原理を用いた液中の微粒子数を測定する機器である。日本薬局方をはじめ、米国、欧州、韓国、中国で定められている薬局方に対応しており、表2に示される様に注射剤に含まれる10
µ m, 25 µmの不溶性微粒子の検査で主に使用される。各国の薬局方はそれぞれ独立した試験規格が定められており、それに応じた装置の標準化(規格への適合)はオプションとして各薬局方の様々な組み合わせに対応できる。
|
表1 KL-05 標準仕様
|
||||||||||||||||||||||||||||||||
|
|
表2 各薬局方の不溶性微粒子試験の判定規格
|
||||||||||||||||||
|
以下に本器の特徴と業務サポート紹介する。
● 表示・制御部とセンサのオールインワンタイプ
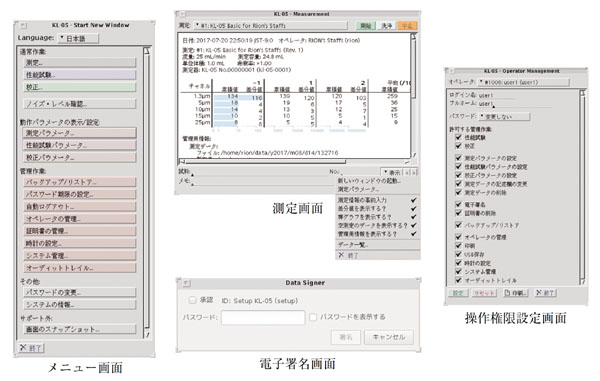
KL-05は、測定やシステム設定などの操作を行うための表示・制御部と微粒子を検出するためのセンサ部を一体としたオールインワンタイプである。前機種のKL-04A
に比べ軽量化しており、また持ち運び易い設計を施している。表示部のディスプレイは10.4 型LCD を採用することで画面サイズを前機種の約2.5
倍に拡大しており、画面の視認性を向上させている。操作性はユーザビリティを考慮して、前機種から基本的に踏襲している。図2に本器の画面例を示す。
 |
|
図2 画面表示例
|
● 微粒子測定
表2の薬局方で定められている不溶性微粒子の判定規格値を設定することで、測定結果の合否判定が自動的に出力される。それらは管理データとしてプリンタや情報管理システムLIMS(Laboratory
Information Management System)へのシリアル通信による出力が可能である。また簡易的なデータ確認や集計用としてテキスト形式や
PDF 形式によるデータ出力も可能としている。
● データインテグリティへの対応
FDA(米国食品医薬品局)の「21 CFR Part11」や PIC/S(医薬品査察協定及び医薬品査察共同スキーム)の「GMP Annex11」などの電子記録、電子署名に関する規制に対応している。これらの規制は測定機器によって得られたデータの完全性を求めるものであり、近年ではユーザ内での意識・関心が高まっている。
本器はパスワード管理や自動ログアウトの設定、ユーザごとの操作権限などの機能を搭載しており、前機種より大幅にセキュリティが強化されている。その他にも、操作履歴を確認するための監査証跡や測定データのバックアップ/リストアなどのシステム機能も備えている。
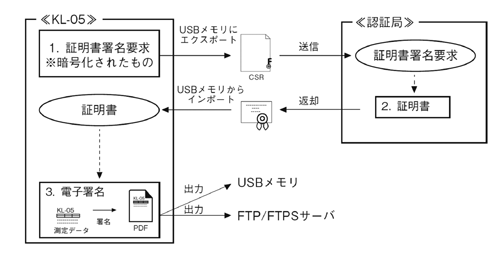
また新たに測定データに対して電子署名する機能が搭載されている。これは電子データの改ざんを防止するため、認証局より発行される証明書を基にタイムスタンプ付の電子データとして出力する。これにより従来の紙媒体からペーパレスな保存が可能となり、サーバへの転送を行うことで、より簡潔なシステムによる品質管理が可能となる。図3に電子署名のフローの概略図を示す。
また測定の結果はSSD(ソリッドステートドライブ)に保存される。SSDは耐久性と堅牢性を考慮して、 MLC タイプを採用している。
 |
|
図3 電子署名までのフロー
|
● 小容量測定への対応
米国薬局方(United State Pharmacopoeia: USP)の<787>で規定されているタンパク製剤の不溶性微粒子試験に対応しており、前機種から容量精度を向上させることで試料容量は0.2
mL から測定可能にした。オプションにはバイアルなどの小容量容器を固定するための試料台と内径Φ 1 mm のSUS 製のサンプリング管を用意しており小容量の測定を可能としている。これらにより、高価な製剤液は最小容量で検査可能になった。図4に小容量測定用のオプション品の外観を示す。
 小容量容器測定用の試料台  SUS 製サンプリング管(内径Φ 1 mm) |
|
図4 小容量測定用のオプション品
|
● バリデーション業務サポート
近年の医薬業界では、医薬品及び医薬部外品の製造管理及び品質管理基準GMP(Good Manufacturing Practice)で謳われるバリデーションの要求として、装置の設置時・運転時の適格性確認や性能の適格性試験が必須となっている。
当社は以前より製品メンテナンスの他にバリデーションサポートも行っており、実施計画に基づき、当製品の設備据付時適格性評価(IQ)や運転時適格性評価(OQ)、性能適格性評価(PQ)の実施・記録書の提供をしている。
■ おわりに
現在、医薬品のグローバル化・国際化に重点が置かれており、日・米・欧による三極薬局方の国際調和が促進されている。今回紹介したKL-05は現在の規制・規格を適合しつつ、今後の医薬業界の動向を捉えた製品となっている。本製品を通じて、ユーザのより良い品質管理の一助となれば幸いである。